Les états de la matière et la notion de pression
Une substance peut se présenter sous différentes formes physiques, selon ses propriétés, la température et la pression. On appelle ces formes les états de la matière. Les trois plus connus sont les solides, les liquides et les gaz. Ce sont les forces entre les molécules et les pressions que ces dernières subissent qui déterminent ces différents états.
La matière est un assemblage plus ou moins organisé d’un très grand nombre d’atomes et de molécules. Un atome est un assemblage de particules élémentaires (noyau de protons et de neutrons, et nuage d'électrons). Une molécule est un assemblage d’atomes.
Les propriétés ou états de la matière dépendent du comportement collectif des entités microscopiques qui la composent (atomes et molécules). Au cœur de la matière règne un mouvement incessant lié à la lutte permanente entre l’ordre et le désordre. Il existe, au sein de la matière, un antagonisme entre une agitation désordonnée des particules élémentaires, et des forces de cohésion qui s'exercent sur elles.
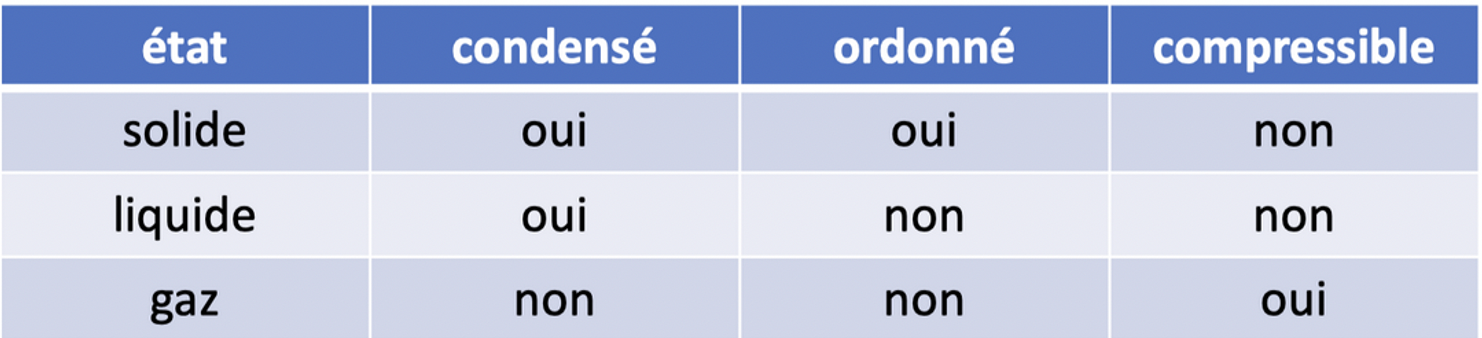
On distingue trois états classiques de la matière : état gazeux, liquide et solide. Il existe d'autres états dont on ne parlera pas ici.
Les différents états de la matière
L' état solide
Un solide possède une forme propre et un volume propre : il dispose d’une forme stable qui ne change pas, sauf si on le soumet à des contraintes. Son volume (en l’absence de perte de matière) reste le même. Il est incompressible.
Les entités chimiques qui constituent un solide possèdent chacune une place bien précise au sein de ce solide, elles ne peuvent pas avoir de mouvement de translation et occupent une position moyenne qui ne varie pas.
En raison d’une localisation et d’une orientation bien précise des entités chimiques dans les solides on dit que l’état solide est un état ordonné.
C’est le seul état de la matière ayant cette caractéristique, les autres états (liquide et gazeux) sont désordonnés.
Les particules élémentaires d’un solide sont proches les unes des autres, l’espace vide qui subsiste est réduit au minimum. L’état solide est un état compact.
L' état liquide
Un liquide ne possède pas de forme propre. Il occupe le fond du contenant qui le reçoit et en épouse la forme.
Un liquide possède un volume propre. Son volume garde la même valeur quel que soit le récipient où il est versé : un volume de liquide reste le même dans un vase rond ou carré, dans une bouteille ou un tube...
Un liquide est un fluide (comme les gaz) et possède (tout comme les gaz) la propriété de pouvoir s’écouler.
Un liquide au repos (sans mouvement) possède toujours une surface libre (surface supérieure en contact avec l’air) plane et horizontale. Ce n’est pas le cas pour les solides (l’éventuelle surface libre n’est pas forcément plane ou horizontale) ni pour les gaz (qui ne disposent en général pas de surface libre).
Les entités chimiques qui constituent un liquide restent au contact les unes des autres (comme dans un solide) et occupent par conséquent un espace réduit : pour cette raison l’état liquide est compact.
Les particules sont libres de se déplacer au sein du liquide mais en restant au contact les unes avec les autres : elles sont toujours en mouvement et ne possèdent pas de position attribuée de manière définitive. L'état liquide un état désordonné.
L' état gazeux
Un corps à l’état gazeux est caractérisé par l’absence de forme propre et de volume propre. Un gaz adopte la forme du récipient qui le reçoit et il occupe tout l’espace qui lui est offert. Son volume dépend du volume du récipient.
Un gaz peut s’écouler, il est compressible et expansible. Si on réduit le volume du récipient, le volume du gaz se réduit et le gaz se comprime. Si on augmente le volume du récipient, le volume du gaz augmente et le gaz s'expand.
Les entités chimiques qui constituent un gaz sont libres de se déplacer dans tout l’espace qui leur est offert : chaque particule suit une trajectoire rectiligne jusqu’à ce qu’une collision (avec une autre entité chimique) modifie la direction de cette trajectoire.
En raison de l’agitation des entités chimiques, un gaz est un état désordonné.
En raison de la dispersion des particules dans l’espace offert, le gaz est un état dispersé.
Pour résumer :
Les liquides sont quasiment incompressibles, mais ils peuvent transmettre la pression aux corps qui les entourent.
Les solides possèdent un volume défini, ils sont incompressibles. Ils possèdent une forme propre et ne sont déformables qu’au prix d’une énergie plus ou moins importante.
Propriétés des gaz
Un gaz est constitué de molécules (ou d'atomes isolés) séparées les unes des autres par des distances bien supérieures à leurs propres dimensions. La légèreté, la compressibilité, l'expansion des gaz est lié au fait qu'il y a beaucoup de vide dans leur structure.
Le volume
On ne peut donc pas parler du volume d’un gaz car les gaz n'ont pas de volume propre. On peut cependant parler du volume occupé par un gaz dans des conditions déterminées. Dans des conditions définies de pression et de température, une masse de gaz occupe un volume déterminé.
Ainsi, un échantillon gaz n’a pas de volume défini : son volume a toujours tendance à augmenter (un gaz est expansible sans limite et de manière spontanée), mais on peut réduire son volume (un gaz est compressible, mais la compression n’est pas spontanée : il faut dépenser de l’énergie pour le comprimer).
La pression
Les molécules d'un gaz sont animées d'un mouvement d'agitation très rapide et complètement désordonné et aléatoires, qui les éloignent les unes des autres. Elles se heurtent entre elles et heurtent la paroi du récipient qui les contient, puis rebondissent. L'effet de ces très nombreux chocs est une force exercée par le gaz sur les parois : on l'appelle la force pressante.
Cette force pressante est toujours dirigée vers l’extérieur du récipient et est perpendiculaire à la paroi de celui-ci.
Le physicien et chimiste irlandais Robert Boyle (1627-1691) et le physicien français Edmé Mariotte (1620-1684) ont démontré qu'il existe une relation entre la pression et le volume d'un gaz. À une température constante et pour un même nombre de molécules, ils ont observé que la pression d'un gaz augmente lorsque son volume diminue, et une diminution du volume d’un gaz entraîne une augmentation de sa pression. Cette relation est nommée "loi de Boyle-Mariotte".
Lorsqu'on réduit le volume d'un gaz, la fréquence des collisions entre les molécules et entre ces dernières et la paroi est plus forte, la pression augmente. À l'inverse, si le volume du contenant est augmenté, la fréquence des collisions est moindre et la pression du gaz devient plus faible.
La diffusion
Un gaz s'écoule toujours d'un milieu où la pression est plus élevée vers un milieu où la pression est plus basse.
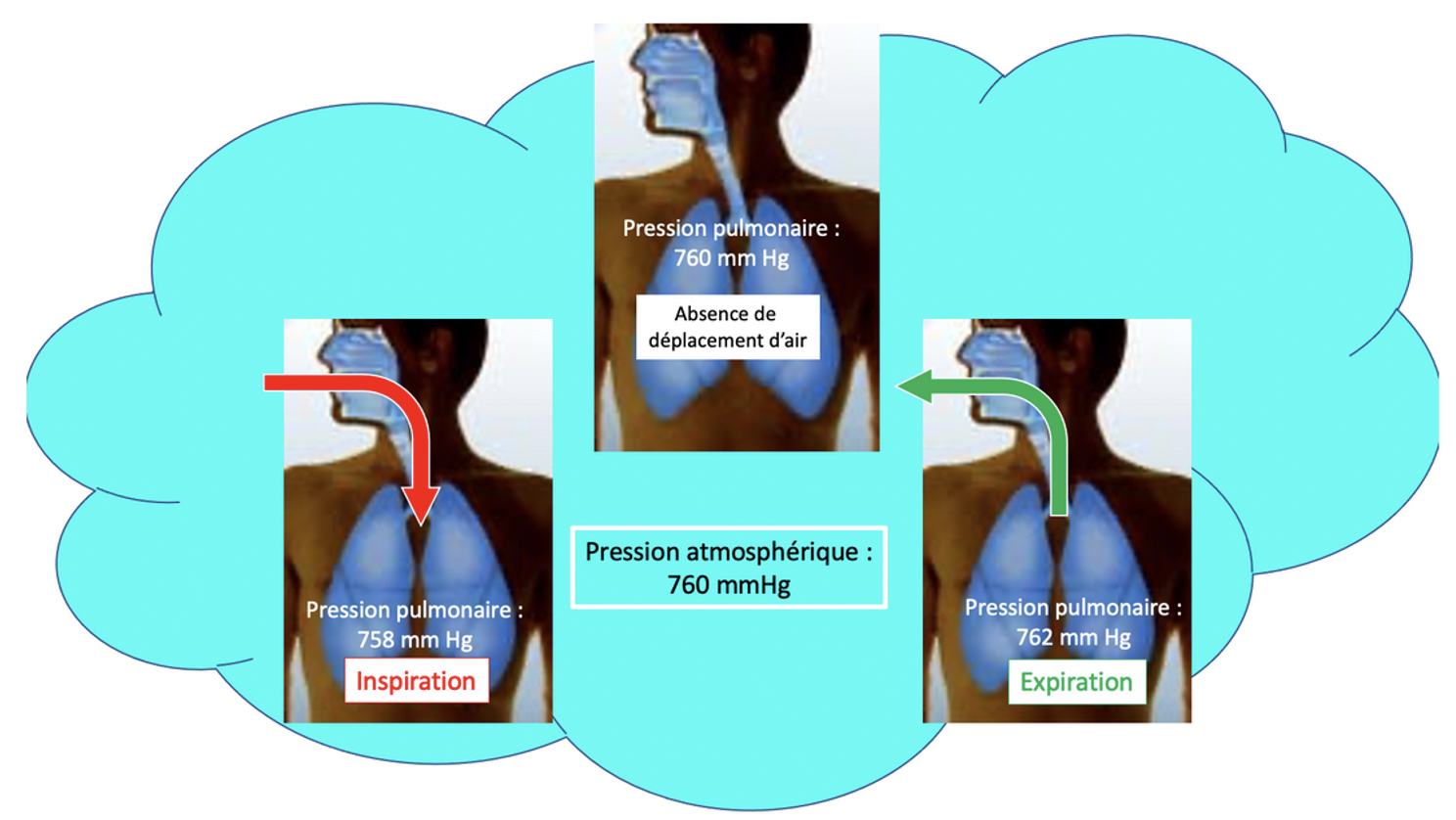
Ces propriétés, volume, pression, diffusion, permettent de comprendre comment se font les déplacements de l'air entre le milieu extérieur (soumis à la pression atmosphérique) et l'intérieur des poumons.
Lorsque le volume pulmonaire augmente, la pression de l'air baisse à l'intérieur des poumons : l'air se déplace de l'extérieur du corps vers l'intérieur (inspiration). Lorsque le volume pulmonaire diminue, la pression de l'air augmente à l'intérieur des poumons : l'air se déplace de l'intérieur du corps vers l'extérieur (expiration).
La notion de pression
Définition
La pression reflète la poussée exercée par les particules composant un corps (solide, liquide ou gazeux) entre elles, entre elles et les parois du récipient qui le contient, et sur les obstacles se trouvant sur son trajet.
Le terme de "pression" renvoie à une force (mesurée en newton N) exercée sur une surface donnée (mesurée en mètres carrés m2). Dans le système international, l'unité de mesure de la pression est le pascal (Pa). Ainsi une pression de 1 Pa correspond à une force de 1 N qui s'exerce sur une surface de 1 m2.
D’autres unités de mesure de la pression peuvent être employées, parfois plus connues que le Pa:
- Le bar (bar) correspond à 105 Pa
- L'atmosphère (atm) correspond à 101.325 Pa
- Le millimètre de Mercure (mmHg) correspond à 133 Pa
- Le centimètre d’eau (cmH20) correspond à 98,06 Pa
La pression est le résultat de l'agitation incessante des atomes et des molécules et de leurs collisions, entre elles, sur des obstacles et sur les parois. La pression s'exerce naturellement dans toutes les directions.
Dans un gaz, elle augmente lorsque la vitesse à laquelle se déplacent les particules augmente (lorsque la température augmente), et quand le volume qui contient le gaz diminue (les collisions sont alors plus nombreuses).
La pression atmosphérique correspond à la pression exercée par l'air contenu dans notre atmosphère. Sa valeur moyenne au niveau de la mer est de 101.325 Pa (soit 1 atm).
Variation de pression lors d’une compression et d'une détente
Une compression est une opération qui consiste, sous une contrainte mécanique (par le biais d’une force exercée), à réduire le volume occupé par une substance sans réduire sa quantité de matière.
Au niveau microscopique elle se traduit par un rapprochement des molécules sans que leur nombre, leur forme, leur nature ou leur volume ne soit modifié.
Les états condensés (solide et liquide) sont constitués de molécules entre lesquelles il n’y a pas d’espace vide par conséquent ces molécules ne peuvent pas se rapprocher, une compression n’y est donc pas possible : seuls les gaz sont compressibles.
Après compression les molécules sont plus resserrées, les chocs moléculaires sont plus nombreux d’où une augmentation de pression : une compression s’accompagne toujours d’une augmentation de pression.
Une détente est l’opération inverse d’une compression. Elle consiste en l’augmentation du volume occupé par le gaz sans augmentation de sa quantité de matière.
Au niveau microscopique une détente correspond à un accroissement de l’espace vide séparant les molécules d’un gaz sans que ces molécules ne soit affectées.
Les liquides et les solides ne peuvent pas subir de détente, seuls les gaz sont expansibles.
Etant donné que les molécules s’éloignent lors d’une détente, les chocs moléculaires deviennent moins nombreux ce qui conduit à une baisse de pression : une détente est toujours accompagnée d’une diminution de pression.